El Agua
estructura, propiedades y funciones
esta imagen es de fuente propia
-Hola a todos amantes de la biología, en esta entrada os hablaré del agua, de su estructura, sus propiedades y funciones, las cuales hemos trabajado y estudiado en clase.
¿Qué es el agua?
El agua es la sustancia más abundante en la materia viva.
Todos los seres vivos tienen una parte formada por agua, en mayor o en menor cantidad dependiendo de cuanta mayor sea la actividad fisiológica que realice el organismo.
-Importante decir que el agua se puede encontrar en materia viva de tres formas diferentes:
- Agua circulante: En la sangre, en la sabía bruta...
- Agua intersticial: Entre las células, fuertemente adherida a la sustancia intercelular formando el agua de imbición, como sucede en el tejido conjuntivo.
- Agua intracelular: En el citosol y en el interior de los orgánulos celulares.
Estructura:
Comenzemos aclarando que el agua es una sustancia dipolar, ya que posee un polo negativo, con densidad electrónica alta, donde está el átomo de oxígeno, y dos polos positivos, donde están los dos hidrógenos , con densidad electrónica baja. Entre las moléculas se establecen fuerzas de atracción denominadas puentes o enlaces de hidrógeno.
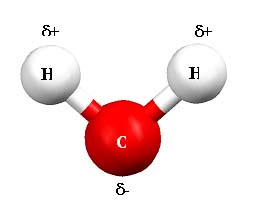
fuente desconocida
Propiedades y funciones:
He decidido explicar las propiedades y funciones juntas porque entre ellas se establecen una serie de relaciones.
- Elevada fuerza de cohesión: Gracias a los enlaces de hidrógeno el agua es un líquido casi incompresible (que a penas se puede comprimir), proporciona volumen a las células, da turgencia a las plantas e incluso constituye el esqueleto hidostático de algunos anélidos. Esta propiedad consigue que el agua tenga una buena capacidad estructural, las células que carecen de una pared de secreción rígida mantienen su volumen gracias a esta propiedad. Por otro lado también buen amortiguador mecánico los vertebrados tienen en las articulaciones móviles bolsas de líquido sinovial que evitan el rozamiento de los huesos.
- Elevada fuerza de adhesión: Las moléculas de agua poseen la capacidad de adherirse a las paredes de pequeños tubos, ascendiendo en contra de la gravedad, esto se conoce como capilaridad. Este fenómeno se debe tanto a la adhesión de las moléculas, como la cohesión entre ellas, existe el ejemplo de la savia bruta. Gracias a esta propiedad se cumple la función de transporte sirve para llevar sustancias del exterior al interior de los organismos.
- Elevada tensión superficial: Su superficie opone resistencia a romperse, lo cual posibilita que algunos organismos vivan asociados a esta película superficial. Gracias a esta propiedad también se da la función de buen amortiguador mecánico.
- Elevado calor específico y elevado calor de vaporización: El elevado calor específico es el calor necesario para elevar la temperatura de una sustancia en un kg, el agua posee un elevado calor específico, se necesita elevar mucho la temperatura, es decir, el grado de agitación de sus moléculas. Esto permite que el agua sea un buen aislante térmico. Por otro lado, para pasar de estado líquido a estado gaseoso se necesitan romper muchos enlaces, esto es sinónimo de necesitar mucha energía, de ahí el elevado calor de vaporización, esto permite que el agua sea un buen refrigerante del organismo, también actúa como regulador térmico. En definitiva, ambas propiedades tienen relación con que el agua es buen termorregulador.
- Densidad más alta en estado líquido que en estado sólido: En estado sólido todos los enlaces de hidrógeno del agua forman un retículo que ocupa mayor volumen que en estado líquido y, por tanto, el hielo es menos denso que el agua. Esto explica que el hielo flote sobre el agua y posibilita la vida bajo el hielo en ríos, mares y lagos.
- Elevada constante dieléctrica: El agua es un buen disolvente(función) de los compuestos iónicos , como sales minerales y de compuestos covalentes polares, como la glucosa; buen reactivo interviene en numerosas reacciones químicas, como la fotosíntesis. Esto se debe a que las moléculas se disponen alrededor de los grupos polares del soluto. En el caso de compuestos iónicos se denomina solvatación o hidratación iónica.
- Bajo grado de ionización: De cada 10^7 de moléculas de agua, sólo una se encuentre ionizada. Esto explica que la concentración de iones (H+) y de iones hidroxilo (OH-) sea tan baja. Dados estos bajos niveles de (H+ y HO-), si al agua se le añade un ácido o una base , aunque sea poca cantidad, estos niveles varían bruscamente.
H2O  H3O+ + OH-
H3O+ + OH-

No hay comentarios:
Publicar un comentario